Ch 01: Corps purs et mélanges au quotidien
Sommaire
I- Corps purs et mélanges
II- Identification d'espèces chimiques
| Activités du chapitre |
|
||||
|---|---|---|---|---|---|
| Compétences du chapitre |
|
||||
| Exercices du livre à traiter: |
p21-27: Ex 12; 13; 14; 24; 25; 29; 31: 35 |
Correction des exercices et des TP
Liste de matériel
I- Corps purs et mélanges
Espèce chimique
I) Corps purs et mélanges
1) Espèce chimique
Définition:On appelle espèce chimique un ensemble constitué d’entités identiques (atomes, ions, molécules etc...)Toute espèce chimique possède un nom.
Elle peut être représentée par sa formule chimique.
Elle possède des grandeurs caractéristiques qui permettent de la reconnaître. Citons par exemple son aspect, sa couleur, sa masse volumique, sa densité, sa solubilité dans l’eau (ou dans un solvant), sa température de fusion, sa température d’ébullition etc…
Remarque : Les espèces chimiques qui existent dans la nature sont dites naturelles .
Certaines sont fabriquées par l’homme ; elles sont dites synthétiques .
On remarquera qu’une espèce chimique synthétique peut être identique à une espèce chimique naturelle.
Corps purs et mélanges
I) Les espèces chimiques
2) Corps purs et mélanges
Définition d'un corps pur: On appelle corps pur une substance constituée d’une seule espèce chimique.
Définition d'un mélange: On appelle mélange une substance constituée de plusieurs espèces chimiques.
Définition d'un mélange homogène: Un mélange est homogène si on ne distingue aucun constituant à l’œil nu.
Exemple: l'eau sucrée est un mélange homogène
Définition d'un mélange hétérogène: Un mélange est hétérogène si on distingue au moins deux constituants à l’œil nu après agitation.
Exemple: l'eau et l'huile forment un mélange hétérogène
La proportion en masse (= Pourcentage massique) d'une espèce E dans un mélange est le quotient de la masse de cette espèce par la masse totale du mélange:x100
Important: les masses doivent être exprimées dans la même unité
La proportion en volume (= Pourcentage volumique) d'une espèce E dans un mélange est le quotient du volume de cette espèce par le volume total du mélange:x100
Important: les volumes doivent être exprimés dans la même unité
La composition d'un mélange peut être décrite par le pourcentage massique ou le pourcentage volumique de chacune des espèces qui constituent ce mélange.
Application: composition de l'air
Soit un volume de 25 L d'air. Sachant que ce volume d'air contient =19,5 L de diazote , =5,25L de dioxygène et le reste étant constitué d'autres gaz (comme l'Hélium (He)....):
- Réponse: =25 - 19, 5 - 5, 25=0, 25L
-
Réponse: Pourcentage volumique de x100= =78%
De même le pourcentage volumique de est de 21%, et il est de 1% pour les autres gaz.
La composition volumique de l'air est donc 78% de diazote; 21% de dioxygène et 1% d'autres gaz
II- Identification d'espèces chimiques
Par les grandeurs physiques
II) Identification d'espèces chimiques
1) Par les grandeurs physiques
Les corps purs ont des caractéristiques physiques qui permettent de les identifier :
les températures de changement d’état, la masse volumique (ou la densité)....
Exemple: température de changement d'état de l'eau et de l'eau salée:
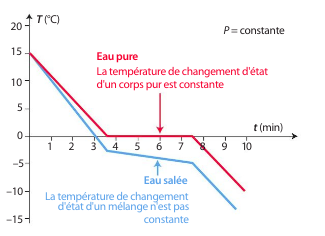
-
La masse volumique ρ d’une espèce ou d’un mélange de masse m et de volume V dépend de la température et s’exprime par :
ρ =
Avec m en g; V en L et ρ en g -
La densité d d’un liquide ou d’un solide s’exprime par :
d=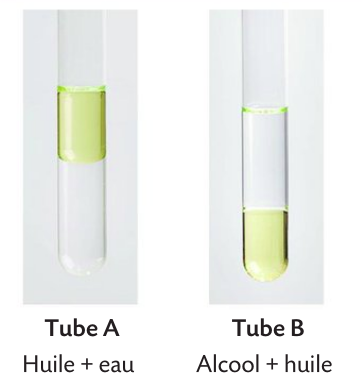
Le mélange le moins dense surnage (à condition de ne pas être miscible avec l'eau).
Par des tests chimiques
II) Identification d'espèces chimiques
2) Par des tests chimiques
Des tests chimiques sont caractéristiques de certaines espèces.-
Test d'identification de l'eau:
Le changement de coloration du sulfate de cuivre anhydre (passe au bleu) indique la présence d'eau -
Test d'identification du dioxyde de carbone CO2
Le blanchissement de l'eau de chaux indique la présence de CO2 -
Test d'identification du dihydrogène (H2):
"L'aboiement" d'un gaz lors de l'approche d'une allumette enflammée est caractéristique de la présence de dihydrogène (H2) -
Test d'identification du dioxygène (O2):
Le retour de la flamme d'une bûchette incandescente plongée dans un gaz est caractéristique de la présence du dioxygène (O2).
Par la chromatographie sur couche mince (CCM)
II) Identification d'espèces chimiques
3) Par la chromatographie sur couche mince (CCM)
La CCM
Définition: La chromatographie sur couche mince (CCM) permet la séparation et l’identification des espèces chimiques présentes dans un mélange.
Correction des exercices et des TP
- Correction TP: distinguer un mélange d'un corps pur
- Correction TP: Mesurer pour estimer la composition d’un mélange
- Correction TP: Réaliser une chromatographie sur couche mince (CCM)
- Correction activité doc: L'air qui nous entoure
- Correction des exercices
Correction TP: distinguer un mélange d'un corps pur
Cliquer iciCorrection TP: Mesurer pour estimer la composition d’un mélange
cliquer iciCorrection TP: Réaliser une chromatographie sur couche mince (CCM)
cliquer iciCorrection activité doc: L'air qui nous entoure
Cliquer iciCorrection des exercices
Cliquer iciListe de matériel
-
TP : Distinguer un mélange d’un corps pur (p 12)
- salle info si tracé informatisé
- flacon d’eau salée sel 200 g/L
- eau distillée
- 2 tubes à essais
- un thermomètre numérique (deux pour faire les deux suivis en même temps?)
- un bécher pour contenir le mélange réfrigérant
- mélange réfrigérant (glace + sel) voir liquide lave-glace (+50% eau)
- pince pour maintenir le thermomètre dans l’eau
- flacon sulfate de cuivre anhydre
- spatule
- li>coupelle
- solution de nitrate d’argent (pour test chlorure)
- balance (si détermination de masse volumique pour les plus rapides)
- 1 pipette graduée 10,0 mL
- 2 béchers pour 10 mL
- Ac. expérimentale : Combien de morceaux de sucres sont dissous dans une canette de Coca Cola®(p14)
- Eprouvette graduée de 100 mL
- Fiole jaugée de 100 mL
- Balance
- Solutions étalons en saccharose en flacon à 4%, 8%, 12% et 16 % ( 150 mL/binôme )
- 1 canette de Coca
- 1 pipette d’ajustage
- Salle info
- Ac. expérimentale : Réaliser une chromatographie sur couche mince (CCM)(p15)
- Cuve à chromatographie
- Plaque à chromatographie
- Eluant (50% eau salée - éthanol)
- 3 tubes capillaires
- coton
- eau distillée
- Bonbons M&M’s (plusieurs couleurs)
- eppendorf avec jaune tartrazine